
28 Jun El fosfato marca la diferencia

Los 20 aminoácidos que conforman las proteínas, agrupados según sus características químicas (fuente)
Las proteínas son las moléculas sobre las cuales recae la inmensa mayoría de funciones celulares. Con una misma base estructural consistente en combinaciones de 20 únicas unidades llamadas aminoácidos, se consigue una heterogeneidad asombrosa. Las proteínas resultantes de estas combinaciones pueden tener una misión eminentemente estructural, convirtiéndose en entramados de moléculas de gran resistencia física (es el caso de la actina y otros componentes del citoesqueleto); pueden actuar como “puertas” en las membranas biológicas que delimitan las células y sus estructuras internas (los transportadores y canales), y también pueden actuar como interruptores que activan o detienen procesos químicos. Dentro de este último grupo encontraríamos a la mayoría de enzimas, proteínas con actividad catalítica. ¿Qué significa esto? Pues que son capaces de facilitar reacciones químicas que de otro modo tardarían muchísimo en tener lugar, o sencillamente ni siquiera llegarían a darse.
Como hemos dicho al principio, la variedad de proteínas es tal, que existen formas de sobra para realizar cada una de las tareas requeridas en la célula. Pero el control al que están sometidos los procesos celulares es fino, muy fino; así que además de existir proteínas para cada proceso, cada una de ellas está sometida a un riguroso control. Cuando uno profundiza, la complejidad aumenta hasta el punto de que una misma proteína puede tener más de una actividad enzimática, puede interaccionar con muchísimas otras proteínas, cuya función puede estar alterando a su vez; y por todo ello, puede participar no sólo un único proceso celular sino en muchos de ellos. Pero, ¿cómo se consigue esto partiendo de una única estructura molecular?
Recordemos que el último paso en la fabricación de una proteína es la traducción. Así se conoce el proceso que da lugar, a partir de la información codificada en el ARN mensajero (que a su vez es una transcripción de la contenida en el ADN genómico), a la cadena de aminoácidos que según se ensamblen y adquieran una estructura tridimensional adecuada formarán la correspondiente proteína. Pues bien, una vez terminada la traducción se puede dar una serie de modificaciones sobre esta estructura, que se llamarán de forma muy poco original (pero bastante esclarecedora) modificaciones postraduccionales. Consisten en pequeñas y sutiles alteraciones de los aminoácidos que forman la proteína, dotándola de propiedades de las que carecía, llegando a cambiar incluso su función. Entre estas modificaciones se encuentran la acetilación, la metilación, la ubiquitilación o la que más me interesa personalmente: la fosforilación. Hablemos un poco más de esta última.
Cuando una proteína se fosforila significa que se le ha añadido un grupo fosfato. Dicho grupo consiste en un átomo de fósforo conjugado con cuatro átomos de oxígeno, en una disposición espacial tetraédrica. Para no entrar en detalles demasiado finos, simplifiquemos: por su estructura y por las características electronegativas de los átomos de oxígeno, cuando a un aminoácido que forma una proteína se le adiciona un grupo fosfato se le está añadiendo una especie de “bolita” con carga negativa. Puede que esto parezca bastante insignificante en una proteína que puede estar formada por muchas cadenas de aminoácidos, pero la adición de esta carga negativa o el volumen extra que supone esta “bolita” puede hacer que se impida la interacción de una proteína con alguna de sus parejas (las proteínas interaccionan unas con otras más a menudo de lo que se pueda pensar, picaronas ellas), o incluso la formación de estructuras complejas de esa misma proteína a partir de varias unidades.
Estructura del grupo fosfato. Los lectores más avispados habrán reconocido el esqueleto de Fosfatín, miembro destacado de la blogosfera científica y mascota oficial de esta edición del Carnaval de Química (modificado de aquí)
La fosforilación se convierte así en un mecanismo de activación e inactivación a modo de interruptores, que es llevado a cabo por proteínas con actividad quinasa (añaden fosfatos), y contrarrestada por proteínas con actividad fosfatasa (eliminan fosfatos). En la mayoría de casos las propias quinasas y fosfatasas ven regulada su actividad por fosforilación, consiguiendo así dotar de mayor complejidad a la fina regulación de procesos tan importantes como el control del ciclo celular. Una de estas proteínas que perdiese la capacidad de ser fosforilada, podría provocar de golpe y porrazo que la célula perdiese el control y se lanzase a dividirse y proliferar vertiginosamente, dando lugar a un crecimiento tumoral no deseado (no deseado por el individuo, las células ni se plantean estas cosas). Este sería, simplificado, el caso de la proteína representada en la figura siguiente.
Os presento a la MAP-quinasa ERK2 en su versión desfosforilada (izquierda, en azul) y fosforilada (derecha, verde). Cuando la quinasa correspondiente añade estos dos fosfatos en ese lugar concreto (flechas rojas), ERK2 cambia su localización celular, se traslada al núcleo y actúa sobre un factor de transcripción que allí se encuentra, desencadenando una respuesta celular ante un estímulo externo. Pero si no se fosforila, se queda por el citosol, ajena al mundo exterior (figura realizada con PyMOL, a partir de PDB: 1TVO y PDB: 2ERK)
Para que un aminoácido se pueda fosforilar debe presentar un grupo hidroxilo (formado por oxígeno e hidrógeno) bien expuesto en su cadena lateral: esto se da en tirosina, serina y treonina principalmente (también en algunas ocasiones fosforilación en histidina y aspártico, sobretodo en procariotas). El oxígeno forma un enlace éster con el grupo fosfato, quedando unido al aminoácido hasta que se produzca una reacción de hidrólisis que restablezca el grupo hidroxilo y libere fosfato inorgánico al medio. Las fosfatasas, se deduce, sólo tienen que «pillar» el grupo fosfato para el que están diseñadas y con la ayudita de un poco de agua (de ahí lo de «hidrólisis»), conseguirán arrancarlo de la proteína. Pero, ¿de dónde sacan el fosfato las quinasas? Pues de un reservorio energético celular que es el ATP. Me suena que hay un torneo de tenis que también se llama así, pero no van por ahí los tiros; ATP es para nosotros adenosín trifosfato, una molécula de la misma naturaleza que los nucleótidos que froman las cadenas de ADN, solo que va sueltecita por ahí cargando tres grupos fosfato seguiditos. De esta forma, la energía que se libera al separar estos grupos fosfato es utilizada por innumerables enzimas para conseguir que las reacciones catalíticas tengan lugar a pesar de requerir un aporte energético externo. Las quinasas, además, aprovechan el fosfato que se libera para adicionarlo a la proteína correspondiente. Como veis, se trata de fenómenos reversibles y transitorios, que en última instancia permiten que la regulación se base en algo más que «si está X proteína presente, sucederá tal cosa»; no amigos, la proteína «X» puede estar fosforilada o no, acetilada, metilada o ubicuitinada; incluso todas estas cosas a la vez. Siempre la misma proteína, pero… con pequeñas diferencias.
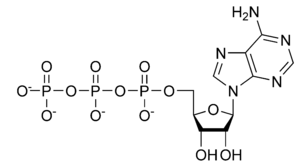
Siento decepcionar a los fans de Fosfatín; «adenosín» no es otro amigable personaje, es esta feota estructura también llamada «trifosfato de adenosina», para evitar confusiones (fuente)
Antes de terminar, es importante mencionar que los grupos fosfato forman parte de muchas otras estructuras moleculares en los sitemas biológicos, razón por la cual el fósforo es un elemento químico importantísimo para la vida. Los lípidos que forman las membranas celulares presentan estos grupos (por eso se llaman fosfolípidos), y en el mismísimo ADN encontramos que una sucesión de fosfatos se encuentran ubicados en la parte externa de la doble hélice. La diferencia es importante: mientras que en estos últimos casos el fosfato está unido a las moléculas aportando una carga negativa de relevancia funcional indispensable para la función normal de dichas moléculas, los grupos fosfato que hemos mencionado en este artículo se añaden a las proteínas de forma puntual, provocando cambios transitorios en mayor o menor medida que además pueden ser eliminados de nuevo. Como se puede apreciar, un mismo compuesto químico puede afectar de manera muy distinta según dónde se adicione. Apenas cinco átomos que pueden constituir una sutil pero muy relevante diferencia.
Esta entrada participa en la XVI Edición del Carnaval de Química, alojada por servidor de ustedes en el blog científico-lúdico ¡Jindetrés, sal!






Pingback:El fosfato marca la diferencia
Publicado el 11:47h, 28 junio[…] El fosfato marca la diferencia http://www.hablandodeciencia.com/articulos/2012/06/28/sutiles-ca… por victortagua hace nada […]
Óskar
Publicado el 18:22h, 28 junioMuy buena y explicativa entrada la que presentas hoy Dr. Felicidades. Quizá un nivel un poco alto para quien no sabe de estas molecularidades jeje, pero muy correcta.
Por poner una pega, ¿Se dice ubiquitilación, no es ubiquitinación?. Pero vamos, que es por ser puntilloso, nada más jejej.
Un saludo y felicidades por la entrada. Ya hacía tiempo que fosfatín no entraba en escena.
Victor Tagua
Publicado el 20:27h, 28 junioHola Oskar
el debate de ubiquitina vs ubicuitina y ubiquitinación vs ubiquitlación lo tuvimos editando el post. En la bibliografía son correctas las dos. Además tanto Litos como yo trabajamos en temas relacionados con esta proteína.
Mi propuesta es que si existe la metilación, acetilación… al añadir grupos metilo, acetilo… pues lo mismo para la ubiquitina que no es un grupo o un radical pero acaba actuando como tal
Y lo dicho, Litos, gran post!! Quizá sea de un nivel más alto pero también hay que ir poniendo cosillas así para todo tipo de público que si no, se nos aburren
Dr. Litos (@DrLitos)
Publicado el 21:56h, 28 junioPues como bien dice Victor por aquí abajo, estuvimos discutiendo la terminología: yo soy más de «ubicuitinación», así con «c» y todo. Pero como dice Victor ambas formas están presentes en la bibliografía, lo malo de que no haya literatura científica en castellano es que luego las traducciones isempre traen confusión. Necesitamos un glosario normalizador urgentemente.
Respecto al nivel de la entrada, me sorprende lo que comentáis porque pensaba que los químicos «de verdad» me iban a canear por hablar de forma tan poco rigurosa, con «bolitas» y cosas parecidas. Creía haber simplificado bastante! Esto de escribir sobre ciencia es harto difícil, con lo ligeramente que se autodenomina cualquiera «divulgador», madre mía.
Pues si queréis más Fosfatín, ¡atentos mañana a Jindetrés! Auqnue ese sí lo he hecho más técnico, aunque también más cachondo que le pega más.
Gracias por comentar!
Bitacoras.com
Publicado el 20:19h, 28 junioInformación Bitacoras.com…
Valora en Bitacoras.com: Los 20 aminoácidos que conforman las proteínas, agrupados según sus características químicas (fuente) Las proteínas son las moléculas sobre las cuales recae la inmensa mayoría de funciones celulares. Con una misma base estr…..
Pingback:Junio en HdC | Hablando de Ciencia | Artículos
Publicado el 13:51h, 02 julio[…] El fosfato marca la diferencia (*) […]
Pingback:Lo más leído de 2012 en HdC | Hablando de Ciencia | Artículos
Publicado el 08:21h, 01 enero[…] Campillo Brocal11. Pequeño pero matón. ¡Ojo con el metanol! de Luis Moreno Martínez 10. El fosfato marca la diferencia del Dr Litos 9. ¿Qué es la vida? de Paulo Hernández8. Umami. El quinto sabor de Víctor Tagua7. […]