
Ácidos, bases y cintas de pH
 Explicar los conceptos de ácido y base no es tarea fácil. Aunque, históricamente, se conocen este tipo de compuestos desde antes de que la Química fuese Química, el hombre tardó cientos de años en conseguir una explicación global a este fenómeno de la “acidez” y “basicidad”. Si te interesa una explicación muy básica de lo que quieren decir, te invito a seguir leyendo.
Explicar los conceptos de ácido y base no es tarea fácil. Aunque, históricamente, se conocen este tipo de compuestos desde antes de que la Química fuese Química, el hombre tardó cientos de años en conseguir una explicación global a este fenómeno de la “acidez” y “basicidad”. Si te interesa una explicación muy básica de lo que quieren decir, te invito a seguir leyendo.
 Comencemos por nuestros amigos los ácidos. El término ácido viene del latín acidus y significa agrio. Lo cual ya nos da una importante pista de su historia: el hombre identificó una serie de sustancias con un sabor particular y unas características comunes y las catalogó con el nombre general de ácidos. Éstas eran productos tales como el jugo del limón, el vinagre, etc. También encontró que estos ácidos (sobre todo los más fuertes) reaccionaban con los metales liberando burbujitas (hidrógeno gas) y corroían los tejidos orgánicos (si les caía en la piel se quemaban seriamente; de ahí la idea popular y alimentada por las películas de que un poco de ácido en el suelo es capaz de agujerearlo, o de dejarnos sin brazo si se nos cae encima, antes de poder decir ayquemequemo).
Comencemos por nuestros amigos los ácidos. El término ácido viene del latín acidus y significa agrio. Lo cual ya nos da una importante pista de su historia: el hombre identificó una serie de sustancias con un sabor particular y unas características comunes y las catalogó con el nombre general de ácidos. Éstas eran productos tales como el jugo del limón, el vinagre, etc. También encontró que estos ácidos (sobre todo los más fuertes) reaccionaban con los metales liberando burbujitas (hidrógeno gas) y corroían los tejidos orgánicos (si les caía en la piel se quemaban seriamente; de ahí la idea popular y alimentada por las películas de que un poco de ácido en el suelo es capaz de agujerearlo, o de dejarnos sin brazo si se nos cae encima, antes de poder decir ayquemequemo).
 Aprovecho para señalar que la realidad, sin embargo, no es tan efectista como en las películas. Y aunque hay que tener cuidado con los ácidos fuertes y concentrados, ni existe el ácido de los xenomorfos de Alien, ni el ácido sulfúrico, por poner un ejemplo, es capaz de hacer grandes agujeros instantáneos en cualquier material. De hecho, aunque reacciona violentamente con el agua (gran poder desecante) y es un potente oxidante (reacciona con la materia orgánica dejando sólo los restos carbonizados al cabo de cierto tiempo) un plástico ni se inmuta en su presencia.
Aprovecho para señalar que la realidad, sin embargo, no es tan efectista como en las películas. Y aunque hay que tener cuidado con los ácidos fuertes y concentrados, ni existe el ácido de los xenomorfos de Alien, ni el ácido sulfúrico, por poner un ejemplo, es capaz de hacer grandes agujeros instantáneos en cualquier material. De hecho, aunque reacciona violentamente con el agua (gran poder desecante) y es un potente oxidante (reacciona con la materia orgánica dejando sólo los restos carbonizados al cabo de cierto tiempo) un plástico ni se inmuta en su presencia.
Las bases, sin embargo, provienen del árabe álcali, que quiere decir ceniza.  Igualmente fácil de adivinar dónde se encontraron este tipo de compuestos por primera vez (sí, en cenizas de plantas). Estos compuestos tenían un sabor amargo, tacto jabonoso, y las bases fuertes podían, al igual que los ácidos, corroer la piel.
Igualmente fácil de adivinar dónde se encontraron este tipo de compuestos por primera vez (sí, en cenizas de plantas). Estos compuestos tenían un sabor amargo, tacto jabonoso, y las bases fuertes podían, al igual que los ácidos, corroer la piel.
Años de investigaciones demostraron que algo común en los ácidos era la presencia de hidrógeno (H) en su fórmula química.
Vamos a apartar esto por un momento. E imaginemos que en el agua (H2O) tiene lugar el siguiente equilibrio químico reversible:
H2O ↔ H+ + OH–
agua ↔ protón + hidroxilo
que quiere decir lo siguiente: una molécula de agua se descompone en un protón (H+) y un anión hidroxilo (OH–). La realidad es más compleja, pero para nosotros será suficiente esta simplificación.
 Se trata de un proceso reversible, es decir, que puede ocurrir tanto en un sentido (el agua se descompone en sus dos componentes) como en el contrario (los componentes se vuelven a unir para dar agua). El término equilibrio se refiere a que la velocidad con la que las moléculas de agua (H2O) forman esos iones es igual a la velocidad del proceso inverso (el que recupera las moléculas de agua). Esto sucede así en el agua pura (agua destilada). En estos compuestos neutros la concentración (cantidad que hay en un volumen determinado) de H+ es igual a la concentración de OH–.
Se trata de un proceso reversible, es decir, que puede ocurrir tanto en un sentido (el agua se descompone en sus dos componentes) como en el contrario (los componentes se vuelven a unir para dar agua). El término equilibrio se refiere a que la velocidad con la que las moléculas de agua (H2O) forman esos iones es igual a la velocidad del proceso inverso (el que recupera las moléculas de agua). Esto sucede así en el agua pura (agua destilada). En estos compuestos neutros la concentración (cantidad que hay en un volumen determinado) de H+ es igual a la concentración de OH–.
A continuación vamos a ver la explicación más sencilla de un ácido y una base, cuando se encuentran en un medio acuoso (en presencia de agua).
Los ácidos tienen protones en su estructura, y los “sueltan” en la disolución acuosa, contribuyendo a aumentar así la cantidad de protones (H+) frente a los aniones hidroxilo (OH–).
 Las bases, por el contrario, son las que contribuyen a aumentar la concentración de los aniones hidroxilo (OH–) cediendo directamente estos iones de su estructura. Aunque también podemos considerar bases las que, sin aumentar estos hidroxilos, hacen disminuir la cantidad de protones (H+) en el agua, retirándolos del medio y haciendo que pasen a formar parte de su propia estructura. En ambos casos, la concentración de OH– se hace mayor frente a la concentración de H+.
Las bases, por el contrario, son las que contribuyen a aumentar la concentración de los aniones hidroxilo (OH–) cediendo directamente estos iones de su estructura. Aunque también podemos considerar bases las que, sin aumentar estos hidroxilos, hacen disminuir la cantidad de protones (H+) en el agua, retirándolos del medio y haciendo que pasen a formar parte de su propia estructura. En ambos casos, la concentración de OH– se hace mayor frente a la concentración de H+.
¿Pero cómo podemos saber si en el agua están aumentando los unos o los otros? Tranquilidad. En la práctica clasificamos a la sustancias en ácidos y bases según su pH (leído pe-hache) que seguro que más de una vez habéis escuchado nombrar, aunque sólo sea en los anuncios. ¿Qué es esto del pH? Literalmente significa -log[H+], es decir, menos logaritmo -log de la concentración [ ] de protones H+ (aunque como siempre, la realidad es más compleja, aquí estoy simplificando la definición). Bien, podéis olvidaros de lo que acabo de escribir. Vamos a traducir a un lenguaje más sencillo qué significa esto en la práctica.
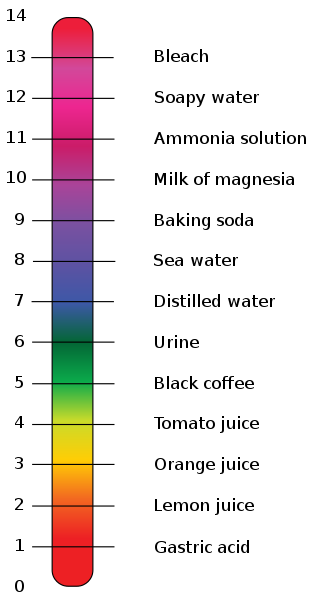 Lo que estamos midiendo con el pH es la cantidad de protones (H+) que hay en la disolución acuosa. Pero, ojo, tal y como está definido, como tiene un signo negativo en su fórmula, da como resultado que cuanto menor sea su valor, mayor será la presencia de protones en el medio. Recordemos que precisamente, los ácidos hacen aumentar esta concentración, así que un valor bajo de pH indica una acidez alta.
Lo que estamos midiendo con el pH es la cantidad de protones (H+) que hay en la disolución acuosa. Pero, ojo, tal y como está definido, como tiene un signo negativo en su fórmula, da como resultado que cuanto menor sea su valor, mayor será la presencia de protones en el medio. Recordemos que precisamente, los ácidos hacen aumentar esta concentración, así que un valor bajo de pH indica una acidez alta.
Y al revés, las bases hacen disminuir esta concentración (bien aumentando la presencia de hidroxilos (OH–) o disminuyendo los protones (H+). Así que un valor alto de pH indica una alta basicidad. Un poco mareante, lo sé. Pero aunque parezca que los químicos lo han hecho para fastidiar, toda esta manera de hacer las cosas tiene su razón de ser, de verdad.
Ya sólo nos queda terminar de explicar lo que es el pH neutro, que está entre los ácidos y las bases. Sería ese pH que tiene el agua pura, cuando la concentración de hidroxilos es igual que la de protones. Una sustancia que tiene ese pH se dice que es una sustancia neutra. Y este valor (podríamos demostrarlo pero para no liar mucho más esto, me vais a creer) es 7.
Con lo cual ya tenemos nuestro baremo: las sustancias con un pH menor que 7 son ácidas (cuanto más bajo este valor, más fuerte será el ácido); las sustancias con un pH mayor que 7 son básicas (cuanto más alto sea este valor, más fuerte será la base); y las sustancias con un pH igual a 7 son neutras. La escala normalmente va de 0 a 14, como se ve en la imagen anterior.
 Ojo con esto del pH neutro, cuando un producto cosmético anuncia en la televisión que tiene pH neutro, no quiere decir pH 7, sino que tiene el mismo pH que la piel, que es de 5,5. Como veis, la piel es ligeramente ácida. Lo ideal es que el jabón que utilicemos tenga el mismo pH que la piel (cuanto más próximo a 5,5 sea su pH, mejor).
Ojo con esto del pH neutro, cuando un producto cosmético anuncia en la televisión que tiene pH neutro, no quiere decir pH 7, sino que tiene el mismo pH que la piel, que es de 5,5. Como veis, la piel es ligeramente ácida. Lo ideal es que el jabón que utilicemos tenga el mismo pH que la piel (cuanto más próximo a 5,5 sea su pH, mejor).
Hay distintas formas de medir el pH de las sustancias. La más sencilla en  el laboratorio es usar el papel tornasol. Se echa una gotita del líquido en él (o introducimos el papel en el líquido, a gusto del consumidor) y según el color resultante, comparamos con una tabla, y sabemos el valor orientativo de su pH. A este tipo de sustancias que nos permiten conocer el pH de otras se les llama indicadores (normalmente porque cambian de color a un pH determinado). También disponemos de ph-metros electrónicos que dan lecturas de pH mucho más exactas.
el laboratorio es usar el papel tornasol. Se echa una gotita del líquido en él (o introducimos el papel en el líquido, a gusto del consumidor) y según el color resultante, comparamos con una tabla, y sabemos el valor orientativo de su pH. A este tipo de sustancias que nos permiten conocer el pH de otras se les llama indicadores (normalmente porque cambian de color a un pH determinado). También disponemos de ph-metros electrónicos que dan lecturas de pH mucho más exactas.
Laboratorio casero
Para finalizar, os invito a realizar un pequeño experimento casero donde podréis poner en práctica todo esto. Hay indicadores naturales que podemos utilizar para comprobar si líquidos que tenemos por casa son ácidos o básicos. Entre ellos están las plantas con antocianinas, que cambian de color al cambiar el pH. Son las responsables de colores azul, rojo y morados de diversas plantas (entre otras, de los frutos rojos). Una gran portadora de antocianinas es la col lombarda, que podemos comprar en nuestra verdulería habitual y de la que podemos hacer un gran indicador casero.
 Hay dos procedimientos para ello:
Hay dos procedimientos para ello:
- – bien la sumergimos en alcohol etílico (disponible en nuestro botiquín)
– o bien la ponemos a hervir en agua.
En ambos casos hay que trocearla antes finamente, y después del proceso, filtrar. Esto puede hacerse con el papel de filtro para el café, por ejemplo. El líquido resultante (de color violeta) será nuestro indicador.
Este líquido es rojo-rosa-violeta en medio ácido, de color azul en el neutro y verde-amarillo en medio básico. Os invito a hacer la prueba con cerveza, vino, diversos zumos, vinagre, lejía, detergente… y todo lo que se os ocurra que tengáis por casa.
También podéis utilizar esto para comprobar que un ácido neutraliza a una base y al revés. En Química se dice que ácido más base siempre da la sal más el agua. Esto da para otro artículo entero, así que lo vamos a dejar de momento pero podéis comprobar como uno de esos líquidos que muestran un color ácido en el indicador, al irle añadiendo una base, el indicador va cambiando de color hacia el neutro. Y viceversa, claro.
Más información sobre esta práctica casera en el magnífico blog de experimentos caseros Cluster.
Espero que os haya resultado de interés y adsequible. Debo añadir que esto es una mera aproximación y el concepto de acidez/basicidad es más amplio y complejo. En cuanto a qué es eso de cationes y aniones que ha ido surgiendo en el texto… eso es otra historia y prometo que será contada en siguientes artículos.
Nota: Esta entrada participa en el IX Carnaval de Química que aloja nuestro blog Hablando de Ciencia en esta edición.
Todas las imágenes pueden encontrarse en la Wikipedia.
María Diz



Jose David
Publicado el 10:56h, 16 noviembreHola. Me ha encantado el articulo. Ya tengo claro el concepto de liquidos acidos y basicos. Eso si, el experimento lo voy a realizar en casa, pero con todos los liquidos que has dicho menos con la cerveza, como comprenderas 🙂
Muchas gracias y saludos.
mariadiz
Publicado el 18:11h, 18 noviembreHombre, siempre puedes probar con una cerveza de lata que no te dé demasiada pena 😉
guillermomarina
Publicado el 20:57h, 16 noviembreÁrticulo sencillo y muy didáctico, fantástico. Y por cierto ya esta apuntado al carnaval.
Un saludo
Bitacoras.com
Publicado el 03:20h, 17 noviembreInformación Bitacoras.com…
Valora en Bitacoras.com: Explicar los conceptos de ácido y base no es tarea fácil. Aunque, históricamente, se conocen este tipo de compuestos desde antes de que la Química fuese Química, el hombre tardó cientos de años en conseguir una explicación gl…..
Pingback:Ácidos, bases y cintas de pH
Publicado el 11:45h, 17 noviembre[…] Ácidos, bases y cintas de pH http://www.hablandodeciencia.com/articulos/2011/11/16/acidos-bas… por adrianmugnoz hace nada […]
Pablo
Publicado el 09:09h, 18 noviembreGracias por explicarlo con una redacción tan amena. Son de esos artículos que los disfrutas saboreándolos hasta el final.
mariadiz
Publicado el 18:12h, 18 noviembreMuchas gracias 😀 Me alegro de que te haya servido.
Pingback:Final del IX Carnaval De Química | Hablando de Ciencia
Publicado el 20:02h, 30 noviembre[…] Ácidos,bases y cintas de Ph en Hablando de Ciencia por María Diz […]
Pingback:PHdC 40: minimizar el daño de los tintes y la vida secreta del arco iris | Hablando de Ciencia | Artículos
Publicado el 08:21h, 05 junio[…] tintes, en particular los que llevan oxidante (agua oxigenada, casi siempre), éstos actúan a un pH alcalino; la combinación de oxidante y álcali (base) es bastante agresiva para el cabello, pero tiene que […]
Pingback:PHdC 51: medicación con o sin comida, y desarrollo sostenible. | Hablando de Ciencia | Artículos
Publicado el 08:23h, 21 agosto[…] ibuprofeno y similares tienen como efecto secundario, el aumento de la acidez gástrica (bajan el pH) y lo hacen de forma indirecta bloqueando los mecanismos para que esa acidez se reduzca (para subir […]
Pingback:Touro: Un paisaje marciano en pleno camino de Santiago | Hablando de Ciencia | Artículos
Publicado el 13:53h, 30 agosto[…] condiciones imposibles para la mayoría de los seres vivos. No en vano, las charcas llegan a tener pH menores de 3. ¡Pobres […]
Pingback:Avelino Corma, Premio Príncipe de Asturias: catalizadores, zeolitas y aplicaciones | Hablando de Ciencia | Artículos
Publicado el 08:16h, 21 junio[…] moléculas están muy ordenadas, formando poliedros y con silicio como átomo principal, y que son alcalinas (lo contrario de ácidas) y que al formar huecos son capaces de retener […]
Willy Uio
Publicado el 18:58h, 31 mayoBueno!!!, claritoo, simple, sencillo!
Maria,….. quieres casarte conmigo?!!!!!
Pingback:Importancia de los catalizadores en la industria – INNOVABlog
Publicado el 07:59h, 20 abril[…] fase líquida, un ejemplo de la catálisis es la reacción de dos sustancias en medio ácido o básico, en el cual el ácido o base reaccionan con las sustancias involucradas, disminuyendo la energía […]
Medidor pH
Publicado el 15:30h, 12 junioMuchísimas gracias por el artículo.
Ha sido un artículo muy útil para las mediciones de pH, y conocer los ácidos y bases.
Un cordial saludo
Begoña
Santi
Publicado el 21:37h, 27 septiembreHa estado muy interesante, ninguna pega y muchas felicitaciones. Me ha sido muy útil y está muy bien explicado.
Martin Boshoff
Publicado el 19:04h, 30 agostoGracias por la explicacion. Un concesionario de Peugeot me ha vendido el producto con acido demasiado alta para limpiar las llantas de mi Peugeot. Me cobranban 250 € para repintarlas. Los otros presupuestos era 360 € y 400 €. Que verguenza !
richard
Publicado el 20:28h, 05 marzome muy interesante
Pingback:Arnold O. Beckman, el gran filántropo e inventor del mundo de la química analítica. | Una bióloga en la cocina.
Publicado el 17:31h, 22 mayo[…] https://www.hablandodeciencia.com/articulos/2011/11/16/acidos-bases-y-cintas-de-ph/ http://www.escuelapedia.com/el-papel-tornasol/ […]